人工金属酶通过将金属辅因子嵌入蛋白质空腔构建而成,从而获得可实现对映选择性转化的新型生物催化剂。因为DNA具备可编程结构、易于合成且成本低廉的优势,这一生物杂化催化剂构筑策略已扩展至DNA-金属杂化催化剂。最初双螺旋DNA与非手性铜(II)配合物相互作用构建了双链DNA杂化催化剂,用于催化了多种水相不对称反应。与双链DNA相比,单链DNA具有多样化的空间构象和丰富的结合位点。典型的富鸟嘌呤单链DNA可在金属离子和介质等条件调控下折叠成不同的鸟嘌呤四链体拓扑结构。鉴于这种结构可塑性,G-四链体DNA(G4DNA)杂化催化剂展现出可调变的催化行为,能够实现产物绝对构型的翻转。尽管G4DNA能提供可调变的手性环境,但其催化效率和转换能力仍有限。因此,通过理性设计构建高效且可调变的DNA杂化催化剂已成为关键研究目标。
王长号教授课题组长期致力于核酸催化化学研究,在前期发现Ag+介导i-motif DNA(imDNA)杂化催化剂高效催化不对称Diels-Alder反应(Angew. Chem. Int. Ed., 2024, 63, e202407838)的基础上。利用四聚体封端策略构建出具有半质子化胞嘧啶-胞嘧啶碱基对(C-H+-C)的铜(II)杂化催化剂(imDNA(H+)/Cu2+),在Friedel-Crafts反应中对映体过量(ee)高达98%。引入Ag+离子将imDNA(H+)重构为独特的imDNA(Ag+)构象,通过4,4’-二甲基-2,2’-联吡啶铜(II)配合物(Cu2+(dmbpy))实现了对映选择性的翻转(高达-93% ee)。主要研究结果如下:
(1)具有封端四聚体的imDNA杂化催化剂设计
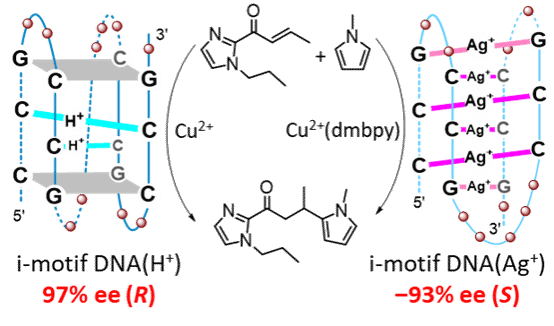
图1. H+/Ag+调控imDNA杂化催化剂催化Friedel-Crafts反应的手性翻转
富含胞嘧啶的单链DNA可以折叠成i-motif结构,由于可编程的胞嘧啶-胞嘧啶碱基配对特性,imDNA作为一种极具前景的手性骨架,正被用于开发可调变的DNA杂化催化剂。研究表明,利用四聚体封端策略构筑了高效的imDNA(H+)杂化催化剂,并在imDNA(H+)/Cu2+与imDNA(Ag+)/Cu2+(dmbpy)体系间实现了手性反转(图1)。相比已报道的dsDNA和G4DNA的不对称催化,imDNA杂化催化剂展现出更优异的对映体选择性,最高分别获得了97%和-93%的ee值。
(2)ODN-1(H+)到ODN-1(Ag+)的结构转变
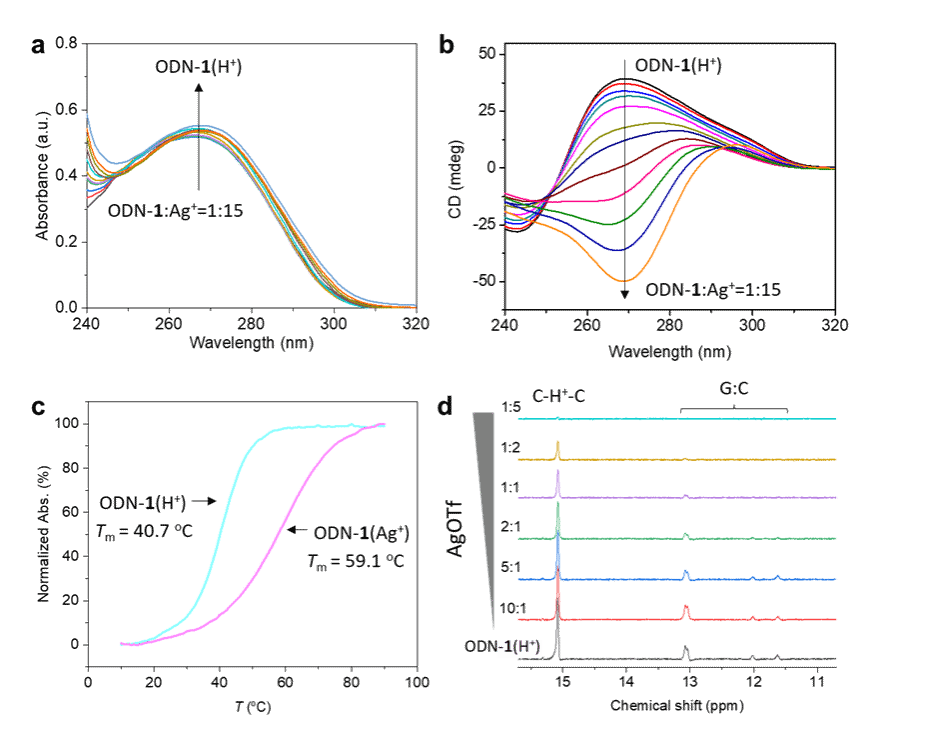
图2. ODN-1(H+)和ODN-1(Ag+)之间的结构转变
为理解手性反转现象,通过一系列物理化学技术手段对ODN-1(H+)与ODN-1(Ag+)的结构差异进行了分析。紫外可见滴定和圆二色滴定实验结果(图2a-b)表明Ag+离子破坏了ODN-1(H+)的螺旋结构及其C−H+−C碱基对堆叠,形成了具有特殊i-motif结构的ODN-1(Ag+)。熔点曲线(图2c)说明Ag+离子的添加增加了DNA的稳定性。最后,通过核磁滴定实验(图2d)确定Ag+离子依次破坏了ODN-1(H+)中的G:C:G:C四聚体和C−H+−C碱基对中的氢键。上述实验说明Ag⁺离子不仅显著稳定了i-motif结构,还重排了其螺旋拓扑结构和碱基堆叠模式。
(3)ODN-1(Ag+)的构象结构
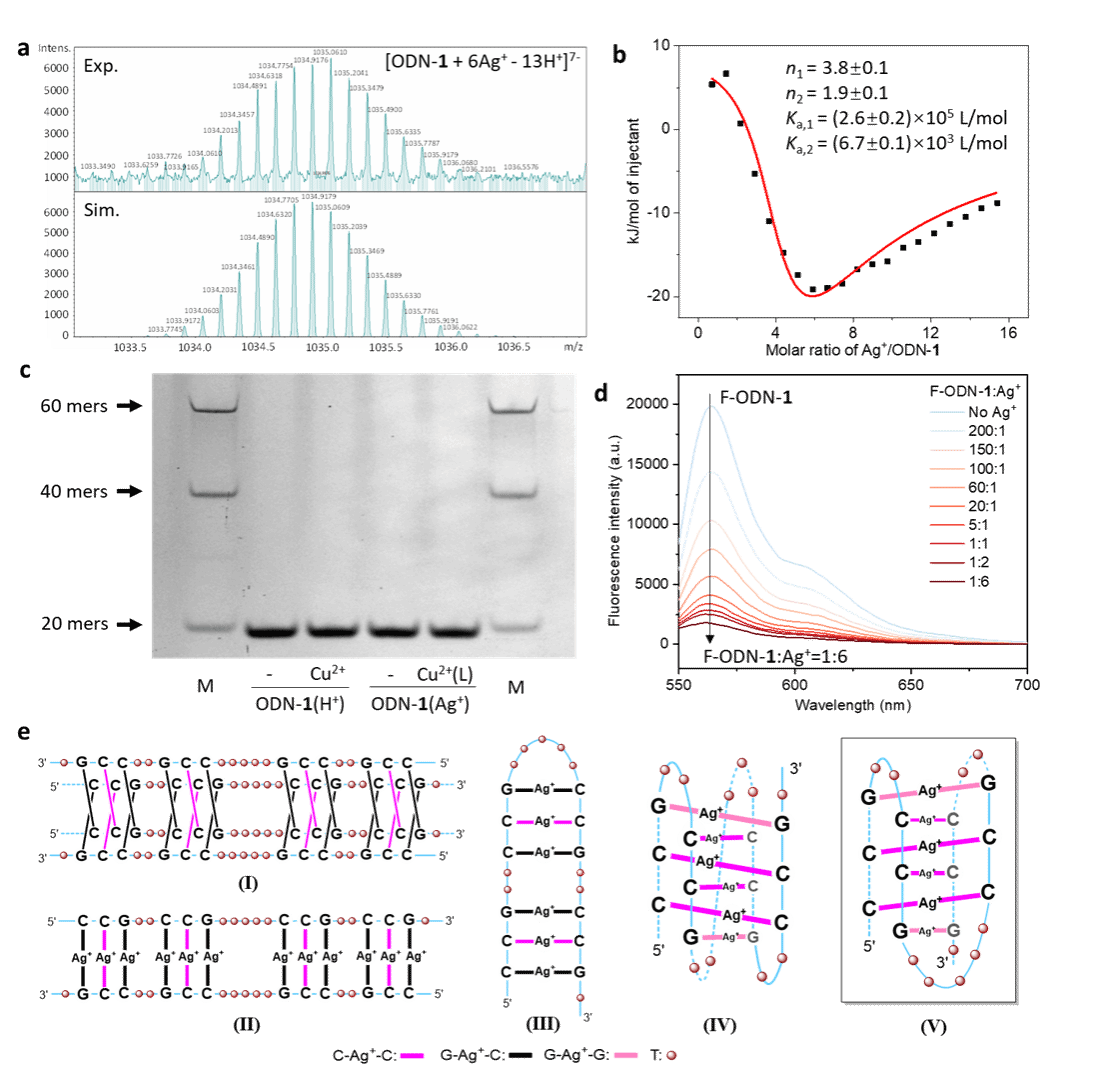
图3. ODN-1(Ag+)的物理化学特性表征及其可能结构
为揭示ODN-1(Ag+)的配位结构,进行了质谱(MS)和等温滴定量热(ITC)(图3a-b)。鉴于ODN-1序列包含8个胞嘧啶和4个鸟嘌呤,提出了6个Ag+离子在ODN-1(Ag+)内形成了4个C−Ag+−C和2个G−Ag+−G碱基对。为探究ODN-1的折叠拓扑结构,采用了聚丙烯酰胺凝胶电泳(PAGE)技术(图3c),说明ODN-1(H+)和ODN-1(Ag+)均是分子内折叠的拓扑结构。为探究DNA的构象变化,进行了荧光共振能量转移(FRET)检测(图3d),实验结果表明Ag+加入造成ODN-1(H+)的5’端和3’端靠近。最后,基于全面的表征数据推测ODN-1(Ag+)的结构最可能为模型V(图3e)。
(4)Cu2+物种与imDNA的可能结合位点
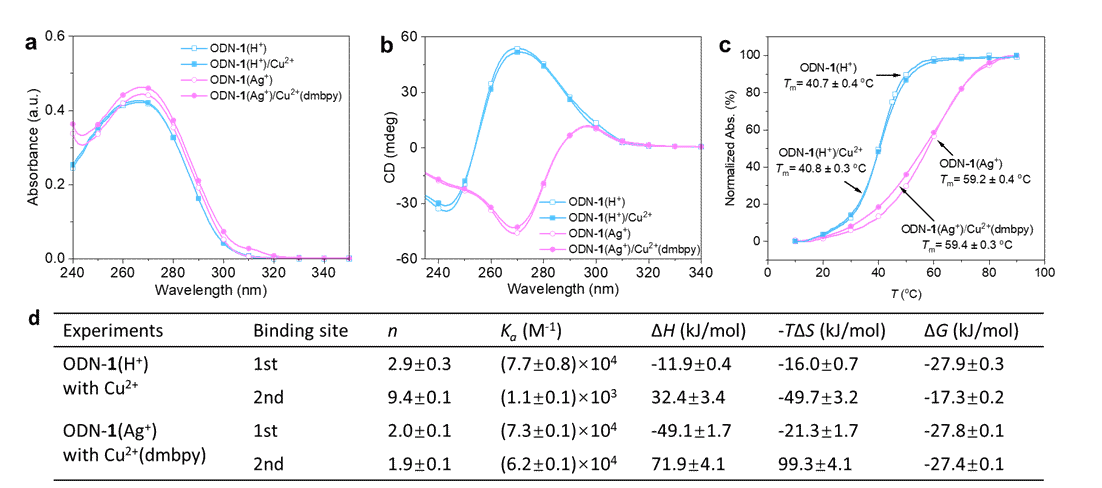
图4. Cu2+物种与ODN-1之间的相互作用
为理解对映选择性的来源,研究了ODN-1杂化催化剂中Cu2+物种的结合位点。紫外可见光谱和圆二色光谱(图4a-c)说明Cu2+物种未破坏核心的i-motif结构。等温滴定实验(图4d)结果表明3个Cu2+离子与imDNA(H+)结合,而两组Cu2+(dmbpy)复合物可能的结合模式涉及G−Ag+−G碱基对的末端堆叠或沟槽结合。
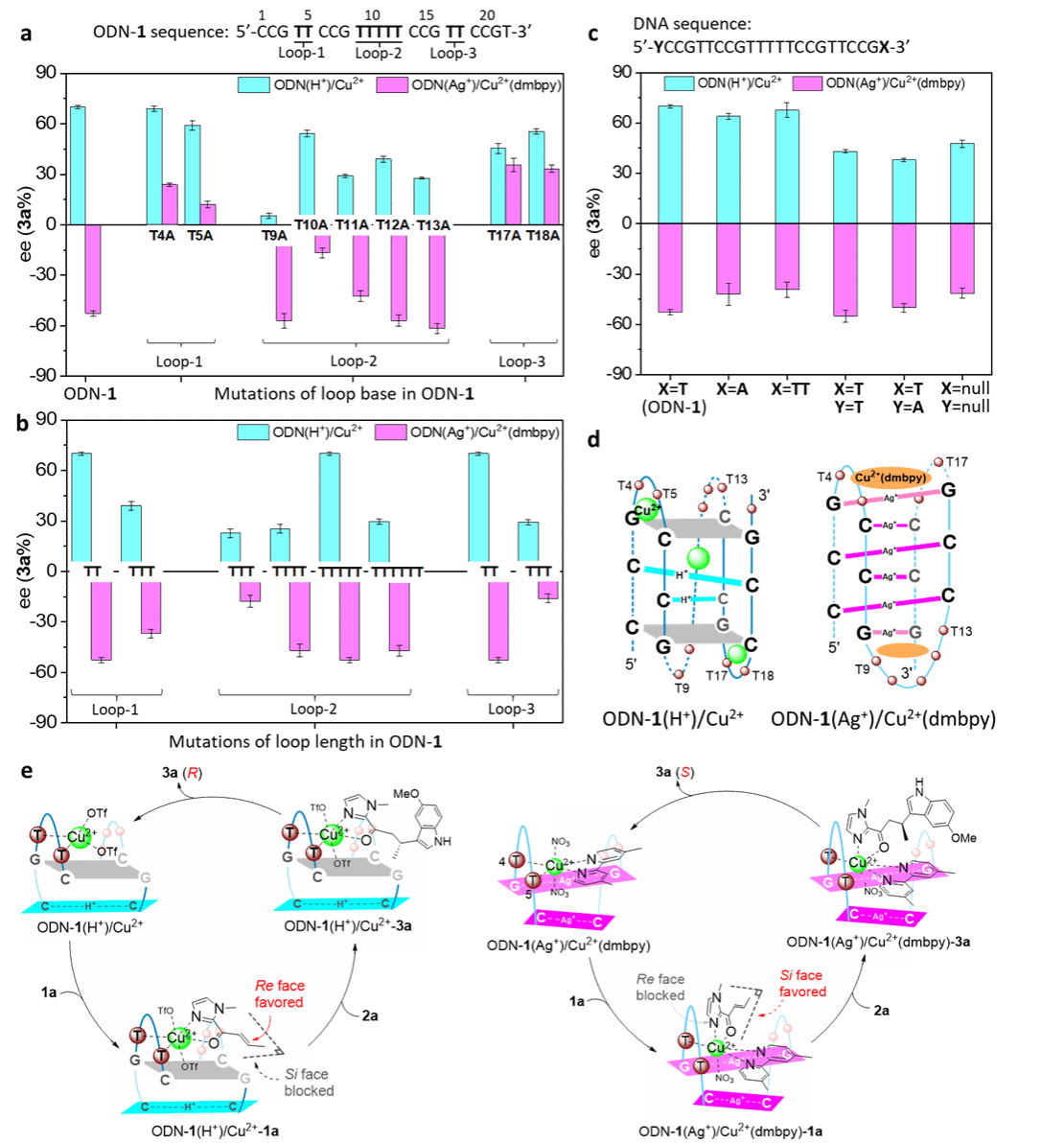
图5. DNA突变实验探测Cu2+物种的位置及其手性翻转机制
为进一步探究Cu2+物种的结合位点,系统地进行了DNA突变实验(图5a-c)。突变实验结果表明3个Cu2+离子位于imDNA(H+)的三个环区,而Cu2+(dmbpy)复合物主要通过与G-Ag+-G碱基对堆叠结合于imDNA(Ag+)的末端区域。基于全面的物理化学表征和突变研究,推测了imDNA杂合催化剂的初步结构模型(图5d)。最后,为阐明手性反转现象,提出了可能的催化机制。手性反转源于H+和Ag+介导的DNA形成具有相反螺旋取向和碱基配对模式的独特i-motif骨架。这些独特的i-motif结构在Cu2+中心周围塑造出截然不同的微环境,从而定向排列含氮、氧的烯酮底物,使其呈现相反的手性面攻击,进而反转了基于DNA的催化反应中的对映选择性。
综上所述,我们建立了一种四聚体封端策略,用于构建高效的imDNA(H+)/Cu2+杂化催化剂,该催化剂在Friedel-Crafts反应中实现了高转化率和高对映选择性(高达98% ee)。该体系可通过引入Ag+和dmbpy重组为imDNA(Ag+)/Cu2+(dmbpy),在保持高反应活性的同时实现对映选择性反转(最高达-93% ee)。手性反转源于H+和Ag+调控的i-motif拓扑结构差异:结构分析表明imDNA(Ag+)的结构采用反平行链取向,由4个C−Ag+−C碱基对和2个G−Ag+−G碱基对稳定,而四聚体封端的imDNA(H+)则截然不同。结合研究和突变分析证实,3个Cu2+离子位于imDNA(H+)的三个环区内,而两个Cu2+(dmbpy)复合物主要通过与G−Ag+−G碱基对的堆叠作用结合在末端区域。这项工作为设计具有增强热稳定性和可调变拓扑结构的高效imDNA杂化催化剂提供了新策略。通过在C−H+−C与Ag+介导的碱基对之间切换实现的手性反转,促进了基于DNA的可控合成,用于制备有价值的手性化合物。除催化领域外,H+和Ag+介导的i-motif可编程构象特性有望拓展其在医药、生物传感及纳米技术领域的应用前景。
相关工作以“H+/Ag+ Switch of Enantioselectivity in i-Motif DNA-Based Friedel−Crafts Reactions”为题发表在J. Am. Chem. Soc.上,2022级物理化学专业博士研究生董星辰为第一作者,王长号教授为唯一通讯作者,我校为唯一通讯单位。感谢国家自然科学基金、中央高校基金、陕西省自然科学基金和陕西师范大学对工作的经费支持。
论文信息:
H+/Ag+ Switch of Enantioselectivity in i‑Motif DNA-Based Friedel−Crafts Reactions
Xingchen Dong a, Weijun Qin a, Zixiao Wang a, Wenqin Zhou b, Shanmei Xu a, Mengyao Wang a, Jin Zhang a, Linna Wang a, Guoqing Jia b, Yashao Chen a and Changhao Wang a,*
J. Am. Chem. Soc. 2026, DOI: 10.1021/jacs.5c20057
https://pubs.acs.org/doi/10.1021/jacs.5c20057
供稿人:董星辰,王长号

 师大主页
师大主页
 手机版
手机版
 English
English